Chapitre svt première: Mutations et santé
Publié le 28/02/2025
Extrait du document
«
Mutations et santé
Il existe de nombreuses maladies génétiques, environ 6 000 connues.
Si certaines se manifestent
systématiquement chez les porteurs du ou des allèles responsables (ex : mucoviscidose, chorée de
Huntington…), le développement de nombreuses autres peut dépendre de facteurs environnementaux.
I - Le déterminisme absolu : la mucoviscidose
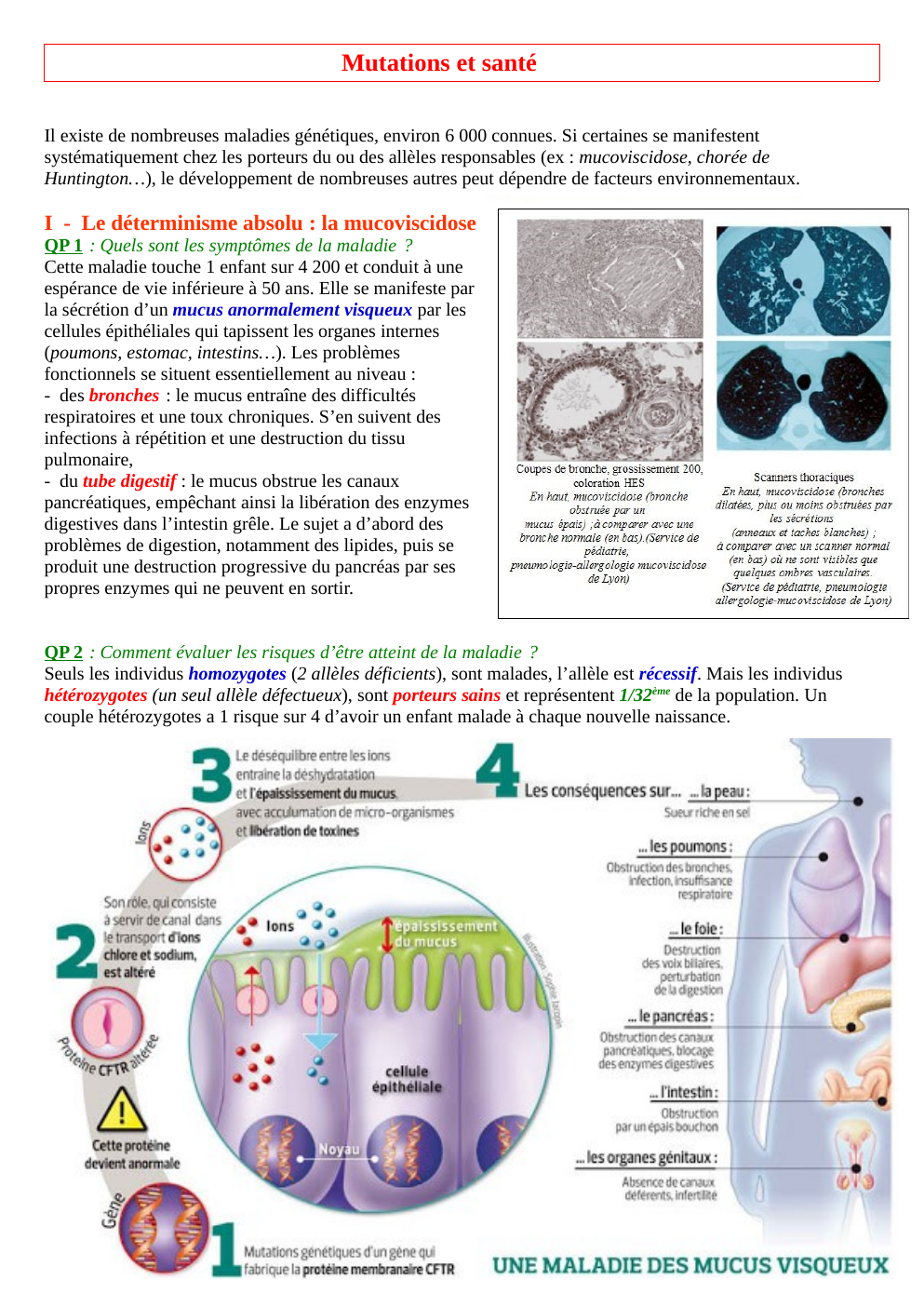
QP 1 : Quels sont les symptômes de la maladie ?
Cette maladie touche 1 enfant sur 4 200 et conduit à une
espérance de vie inférieure à 50 ans.
Elle se manifeste par
la sécrétion d’un mucus anormalement visqueux par les
cellules épithéliales qui tapissent les organes internes
(poumons, estomac, intestins…).
Les problèmes
fonctionnels se situent essentiellement au niveau :
- des bronches : le mucus entraîne des difficultés
respiratoires et une toux chroniques.
S’en suivent des
infections à répétition et une destruction du tissu
pulmonaire,
- du tube digestif : le mucus obstrue les canaux
pancréatiques, empêchant ainsi la libération des enzymes
digestives dans l’intestin grêle.
Le sujet a d’abord des
problèmes de digestion, notamment des lipides, puis se
produit une destruction progressive du pancréas par ses
propres enzymes qui ne peuvent en sortir.
QP 2 : Comment évaluer les risques d’être atteint de la maladie ?
Seuls les individus homozygotes (2 allèles déficients), sont malades, l’allèle est récessif.
Mais les individus
hétérozygotes (un seul allèle défectueux), sont porteurs sains et représentent 1/32ème de la population.
Un
couple hétérozygotes a 1 risque sur 4 d’avoir un enfant malade à chaque nouvelle naissance.
QP 3 : Quelle est l’origine de cette maladie ?
C’est la mutation d’un gène situé sur le chromosome 7 et codant pour la protéine CFTR.
Chez les 2/3 des
malades, la protéine mutée ne diffère de la normale que par délétion d’un acide aminé, en position 508 (voir
livre p.317).
La protéine produite ne remplit plus son rôle de transporteur des ions Cl- au travers de la membrane cellulaire,
cet ion étant essentiel à la fabrication d’un mucus fluide.
Les malades sécrètent alors un mucus visqueux qui
s’évacue difficilement, s’accumule dans les bronches favorisant le développement des bactéries pathogènes.
Les infections sont beaucoup plus fréquentes et aboutissent à une destruction progressive du tissu pulmonaire.
II - Les traitements, aujourd’hui et demain
QP 4 : Quels traitement sont utilisés pour lutter contre la mucoviscidose ?
Les traitements actuels sont axés sur la kinésithérapie respiratoire pour aider le patient à se libérer des
sécrétions qui encombrent les bronches et une hygiène de vie stricte.
Médicaments fluidifiants le mucus,
antibiotiques en cas d’infection, ainsi que l’oxygénothérapie permettent d’aider au mieux les patients.
Dans les
cas extrêmes, une greffe des poumons est envisagée, à condition de trouver un donneur compatible.
Une thérapie génique est en cours d’essai.
Elle consiste à faire inhaler par nébulisation des vecteurs (virus
inoffensif ou microparticule lipidiques) contenant le gène sain inséré par transgénèse.
Les cellules épithéliales
« infectées » vont alors produire une protéine saine.
Le traitement doit être répété régulièrement, les cellules
épithéliales ayant une durée de vie relativement courte (qq semaines) et son bénéfice n’est à ce jour que de 4 %.
III – L’épigénétique, le choix d’activer ou non notre génome
Alors que la génétique correspond à l’étude des gènes, l’épigénétique
s’intéresse à une «couche» d’informations complémentaires qui définit
comment ces gènes vont être utilisés par une cellule… ou ne pas l’être.
En d’autres termes, l’épigénétique correspond à l’étude des
changements dans l’activité des gènes, n’impliquant pas de
modification de la séquence d’ADN et pouvant être transmis lors des
divisions cellulaires.
Contrairement aux mutations qui affectent la
séquence d’ADN, les modifications épigénétiques sont réversibles.
Elles sont induites par l’environnement au sens large : la cellule reçoit
en permanence toutes sortes de signaux l’informant sur son
environnement, de manière à ce qu’elle se spécialise au cours du développement, ou ajuste son activité à la
situation.
Ces signaux, y compris ceux liés à nos comportements (alimentation, tabagisme, stress…), peuvent
conduire à des modifications dans l’expression de nos gènes, sans affecter leur séquence.
Le phénomène peut
être transitoire, mais il existe des modifications épigénétiques pérennes, qui persistent lorsque le signal qui les
a induites disparaît.
Source https://www.inserm.fr/dossier/epigenetique/
Aller plus loin : mucoviscidose et thérapies géniques
Selon Anne GALLY de France Assos Santé :
LA MÉTHODE « IN VIVO »
Elle consiste à injecter des gènes thérapeutiques, qui corrigeront l’anomalie génétique, directement dans le
corps du patient.
Ces gènes sont « transportés » par des vecteurs viraux, c’est-à-dire des virus inoffensifs.
On utilise des vecteurs comme les virus adéno-associés (AAV) qui, une fois injectés dans le corps du patient,
circuleront partout mais rentreront plus particulièrement dans un certain type de cellules que l’on a ciblé, sans
jamais s’intégrer au génome.
Dans un tel cas de figure, si la cellule se divise, le vecteur se dilue et perd en
efficacité thérapeutique.
C’est pourquoi on favorise cette méthode non-intégrative (elle ne modifie pas l’ADN)
pour soigner des tissus qui ont fini de grandir comme les yeux, le muscle, le foie, puisque les cellules de ces
tissus se divisent peu et que le vecteur se diluera peu.
Ainsi, même s’il s’agit de tissus qui ont terminé leur
croissance, et dans la mesure où l’on a encore assez peu de recul sur ces traitements, on ne sait pas combien de
temps l’effet thérapeutique peut perdurer chez les patients, mais on espère que cela se comptera en années.
MAIS, le problème à ce jour est que les vecteurs que nous utilisons sont des particules virales qui déclenchent
donc une réponse immunitaire chez la personne qui les reçoit.
Les patients exposés à ces virus s’immunisent
contre ces vecteurs.
Ils sont en réalité vaccinés contre ces virus.
Par conséquent, leurs anticorps repéreront le
vecteur et le bloqueront.
C’est un point particulièrement problématique chez les enfants puisqu’il y a de fortes
chances qu’ils aient à nouveau besoin de nouvelles injections de vecteurs au cours de leur vie.
On a des
parades, comme le fait de chercher de nouveaux vecteurs-viraux ou de donner un traitement immunodépresseur
au moment d’administrer le vecteur pour éviter que le patient ne soit immunisé et puisse à nouveau recevoir le
même vecteur.
LA MÉTHODE « EX VIVO »
Elle consiste à prélever des cellules chez le malade, à les modifier génétiquement en laboratoire, toujours à
l’aide de vecteurs viraux, puis à les réinjecter au malade.
Pour y parvenir, on choisit des cellules particulières appelées « cellules souches », qui sont capables de
reproduire un tissu ou un organe duquel elles sont issues.
Ces approches-là se pratiquent beaucoup pour les
maladies sanguines car on connaît bien les cellules souches sanguines, qu’on appelle les cellules
hématopoïétiques.
On les utilise quotidiennement pour faire des « greffes de moelle », qui sont finalement des
transplantations de cellules souches d’une personne à une autre.
Quand on ne peut pas trouver de donneur
compatible, on prend les cellules souches du patient lui-même, on les modifie génétiquement en laboratoire et
on les lui réinjecte.
Dès lors, les cellules souches vont se comporter comme elles savent le faire, à savoir, dans le cas des cellules
hématopoïétiques, refaire quotidiennement des milliards de cellules sanguines.
De cette façon, elles
transmettent à leur descendance la mutation qui a été effectuée en laboratoire.
Comment se passe la manipulation génétique ?
Cette approche ex-vivo ne peut se faire que sur des cellules que l’on peut manipuler en laboratoire et
aujourd’hui il n’y a pratiquement que les cellules sanguines ou celles du système immunitaire que l’on peut
modifier, car ce sont des cellules circulantes qui constituent un tissu liquide (et non solide comme le muscle),
qui sont plus faciles à prélever, à manipuler et à réinjecter que les autres cellules souches tissulaires.
Cependant il y....
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- 1ère Spé SVT Thème 2 : La dynamique interne de la Terre. Chapitre 1 : La structure interne du globe terrestre
- Chapitre SVT: Produire le mouvement
- fiche de révision chapitre de l'ATP terminale spé SVT
- Chapitre 1 : Croissance économique, mondialisation et mutations des sociétés depuis 1850 (éco)
- SVT – Chapitre 01 (géologie)