Les sucres en synthèse chirale
Publié le 30/05/2015

Extrait du document
. La plupart dérivent sans doute de la condensation de formes biologiquement activées de l'acide propionique selon 8.44. On rencontre aussi les séquences désoxygénées. Pour construire ces séquences à partir d'enchaînement de sucres, un des problèmes est l'introduction stéréospécifique de ramifications méthyle. Un chiron possible est la D-ribonolactone 8.45. La protection sélective de la fonction alcool primaire et la dérivation du système diol avec le thiocarbonyl bis imidazo-le 8.46 donnent le thionocarbonate 8.47. Le traitement de 8.47 au nickel de Raney produit une élimination et conduit à la lactone non saturée 8.48. L'addition de Michaël du réactif volumineux (MeS)3CLi a lieu en trans de C(5). On oxyde directement l'énolate avec un peroxyde du molybdène et, là encore, un facteur d'encombrement introduit l'hydroxyle stéréospécifiquement en trans, donnant en une seule opération 8.49. Le substituant soufré est réduit en méthyle par le nickel de Raney. On a ainsi introduit spécifiquement la ramification carbonée. De là on passe à 8.50 par des transformations classiques. Nous avons porté la numérotation de la ribonolactone pour permettre au lecteur de suivre les avatars du sucre. On
«
128 Les sucres en synthèse chirale
I
l
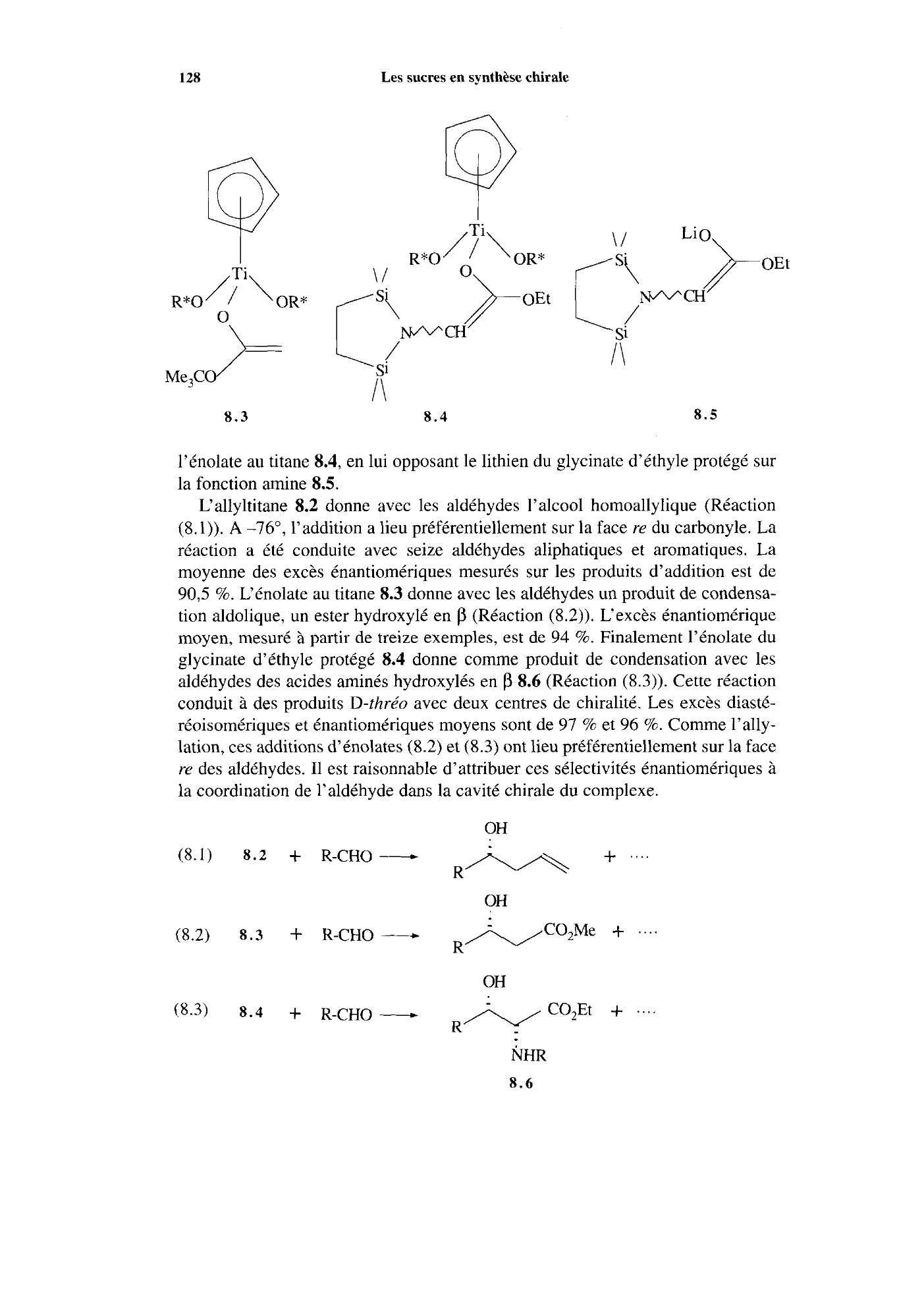
/Ti
8.3 8.4 8.5
l’énolate au titane 8.4, en lui opposant le lithien du glycinate d’éthyle protégé sur
la fonction amine
8.5.
L‘allyltitane 8.2 donne avec les aldéhydes I’alcool homoallylique (Réaction
(8.1)).
A -76”, l’addition a lieu préférentiellement sur la face re du carbonyle.
La
réaction
a été conduite avec seize aldéhydes aliphatiques et aromatiques.
La
moyenne des excès énantiomériques mesurés sur les produits d’addition est de
90,5 %.
L‘énolate au titane 8.3 donne avec les aldéhydes un produit de condensa-
tion aldolique, un ester hydroxylé en
p (Réaction (8.2)).
L‘excès énantiomérique
moyen, mesuré
à partir de treize exemples, est de 94 %.
Finalement l’énolate du
glycinate d’éthyle protégé 8.4 donne comme produit de condensation avec les
aldéhydes des acides aminés hydroxylés en
p 8.6 (Réaction (8.3)).
Cette réaction
conduit
à des produits D-thréu avec deux centres de chiralité.
Les excès diasté-
réoisomériques et énantiomériques moyens sont de
97 % et 96 %.
Comme l’ally-
lation, ces additions d’énolates
(8.2) et (8.3) ont lieu préférentiellement sur la face
re des aldéhydes.
I1 est raisonnable d’attribuer ces sélectivités énantiomériques à
la coordination de l’aldéhyde dans la cavité chirale du complexe.
OH
+ ....
A/\ (8.1) 8.2 + R-CHO - R
OH
C0,Me + ....
(8.2) 8.3 + R-CHO RA/
OH
CO,Et + ....
R (8.3) 8.4 + R-CHO -
NHR
8.6.
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- Document de synthèse Méthodes contraceptives
- Synthèse : extrait 5 "Supplément au voyage de Bougainville" de Diderot
- Corrigé TP : SYNTHÈSE DE L’ASPIRINE
- Synthèse innovation 1
- Note de synthèse Sur les principales dispositions de la réforme des soins en milieu pénitentiaire