Les oligosaccharides : Configuration et analyse
Publié le 30/05/2015
Extrait du document
Le chimiste qui désire connaître la structure d'un oligosaccharide naturel conjugué doit en général travailler sur un mélange d'espèces très voisines. Il y a en effet le problème de l'hétérogénéité naturelle de ces structures, même sur un support protéique homogène, et de l'hétérogénéité artificielle provoquée par les réactifs de clivage — car il n'est pas concevable d'étudier le glycoconjugué dans son ensemble. Il est donc nécessaire de procéder d'abord à un fractionnement, particulièrement difficile entre structures très voisines. L'analyse du spectre de RMN du proton, telle qu'elle sera décrite dans ce paragraphe[91, donne une indication sur l'homogénéité de l'échantillon, puisqu'un mélange donne une superposition des signaux, dont on peut connaître l'appartenance par la considération des intensités.
En raison de la grande complexité du problème de structure, il est nécessaire de connaître les valeurs de S avec trois décimales. Ceci impose un champ magnétique très élevé (jusqu'à 14 Tesla) pour une fréquence de travail de 500 ou 600 MHz. Le traitement informatique des données permet d'augmenter la résolution et de descendre jusqu'à des concentrations 0,05 mM de l'échantillon. Même à cette fréquence les signaux des protons squelettaux non anomériques des divers sucres se superposent en une large bande non résolue entre 3,4 et 4,0 p.p.m. L'analyse repose sur un groupe de signaux, les indicateurs, situés en dehors de cette région. Ils correspondent aux protons énumérés ci-dessous.
«
142 Les oligosaccharides : Configuration et analyse
HO
O~o~04~~H OH HO Hio& HO H n OH
OH
9.1
OH
9.2
et les polysaccharides apparentés, ou même un tri-, un tétrasaccharide comme
dans les antigènes bactériens.
Depuis une vingtaine d’années, on
a été amené à
attacher une importance particulière à une classe de molécules intermédiaires
appelées de façon imprécise les
oligosaccharides : ce nom recouvre tous les
degrés‘ de condensation, depuis deux jusqu’à un maximum mal défini, une ving-
taine peut-être d’unités mono-saccharidiques.
Ce classement n’est pas dicté par la
chimie, mais par l’activité fréquemment observée de certains représentants dans
les phénomènes de reconnaissance.
I1 n’y
a aucune régularité évidente dans ces
édifices, auxquels la suite de cet ouvrage sera désormais presque uniquement
consacrée.
Dans la nomenclature préconisée, un oligosaccharide est un composé dont
l’hydrolyse complète donne un nombre restreint de monosaccharides.
Un disac-
charide non réducteur est décrit comme
un glycosylglycoside.
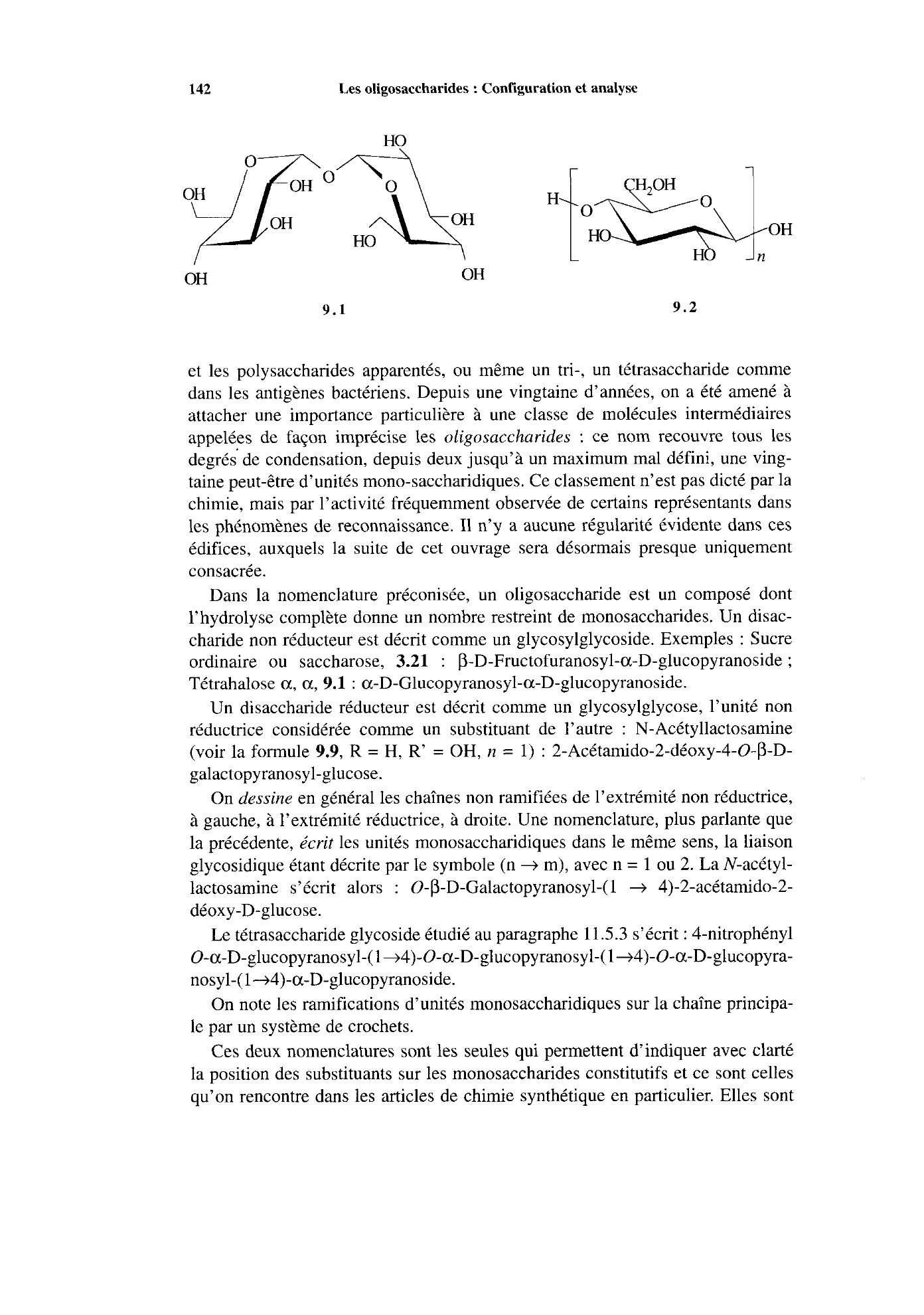
Exemples : Sucre
ordinaire ou saccharose,
3.21 : p-D-Fructofuranosyl-a-D-glucopyranoside ;
Tétrahalose a, a, 9.1 : a-D-Glucopyranosyl-a-D-glucopyranoside.
Un disaccharide réducteur est décrit comme un glycosylglycose, l’unité non
réductrice considérée comme un substituant de l’autre
: N-Acétyllactosamine
(voir la formule
9.9, R = H, R’ = OH, n = 1) : 2-Acétamido-2-déoxy-4-O-~-D-
galactopyranosyl-glucose.
On dessine en général les chaînes non ramifiées de l’extrémité non réductrice,
à gauche, à l’extrémité réductrice, à droite.
Une nomenclature, plus parlante que
la précédente, écrit les unités monosaccharidiques dans le même sens, la liaison
glycosidique étant décrite par le symbole (n
+ m), avec n = 1 ou 2.
La N-acétyl-
lactosamine s’écrit alors
: O-P-D-Galactopyranosyl-( 1 + 4)-2-acétamido-2-
déoxy-D-glucose.
Le tétrasaccharide glycoside étudié au paragraphe 11 S.3 s’écrit : 4-nitrophényl
O-a-D-glucopyranosyl-(
1 +4)-O-a-D-glucopyranosyl-( 1 +4)-O-a-D-glucopyra-
nosyl-(
1 +4)-a-D-glucopyranoside.
On note les ramifications d’unités monosaccharidiques sur la chaîne principa-
le par un système de crochets.
Ces deux nomenclatures sont les seules qui permettent d’indiquer avec clarté
la position des substituants sur les monosaccharides constitutifs et ce sont celles
qu’on rencontre dans les articles de chimie synthétique en particulier.
Elles sont.
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- Analyse de la configuration organisationnelle de Sushi Shop Waterloo
- analyse linéaire Les caractères Giton et Phédon
- Analyse "Pensées pour soi" de Marc Aurèle
- analyse linéraire pour l'oral du bac sur le text liminaire de l'épitre dédicatoire de Louise Labé
- ANALYSE LINEAIRE ELLE ETAIT DECHAUSSE