Terminale - Spécialité ACTIVITE EXPERIMENTALE N°11 - SUIVI CINETIQUE D’UNE REACTION
Publié le 19/03/2024
Extrait du document
«
Terminale - Spécialité
ACTIVITE EXPERIMENTALE N°11 - SUIVI CINETIQUE D’UNE REACTION
Pour étudier une vitesse de réaction, il faut utiliser le suivi de la concentration d’au moins une des espèces
chimiques présentes dans l’équation bilan.
➢ Objectifs de l’activité : Comment suivre une transformation impliquant une espèce colorée ?
Peut-on modéliser l’évolution de la concentration d’une espèce au cours du temps ?
Document 1 : Conditions expérimentales
Les ions peroxodisulfate S2O82−(aq) et les ions iodure I−(aq) réagissent selon l’équation de réaction :
S2O82−(aq) + 2 I−(aq) → 2 SO42−(aq) + I2(aq)
Pour étudier cette réaction, on se propose de suivre l'évolution au cours du temps de la concentration
en diiode I2(aq) formé, seule espèce chimique colorée.
La concentration en iodure de potassium (K+(aq) ; I−(aq)) apporté est égale à 1,0 mol·L-1 et celle du
peroxodisulfate de potassium (2 K+(aq) ; S2O82−(aq)) à 5,0 × 10−3 mol·L-1.
Document 2 : Protocole expérimental
•
•
•
•
•
•
•
•
Régler la longueur d’onde du spectrophotomètre sur 490 nm.
Faire le blanc avec un mélange de 20,0 mL de solution (K+(aq) ; I−(aq)) et 25,0 mL d’eau distillée (déjà
préparé).
Verser 20,0 mL de solution d'iodure de potassium (K+(aq) ; I−(aq)) dans un bécher n°1.
Dans un bécher n° 2, verser 5,0 mL de solution de peroxodisulfate de potassium (2 K+(aq) ; S2O82−(aq))
et 20,0 mL d’eau distillée.
Le placer sur un agitateur magnétique et agiter.
Verser le contenu du bécher n°1 dans le second en déclenchant le chronomètre.
Remplir rapidement à l'aide d'une pipette en plastique une cuve avec ce mélange et l’introduire
dans le spectrophotomètre.
Relever les valeurs de l’absorbance 𝐴 de la solution en fonction du temps 𝑡 toutes les 10 secondes
pendant 2 min puis toutes les min jusqu'à atteindre 20 min de réaction.
Tracer la courbe représentant l’absorbance A en fonction du temps sur Regressi.
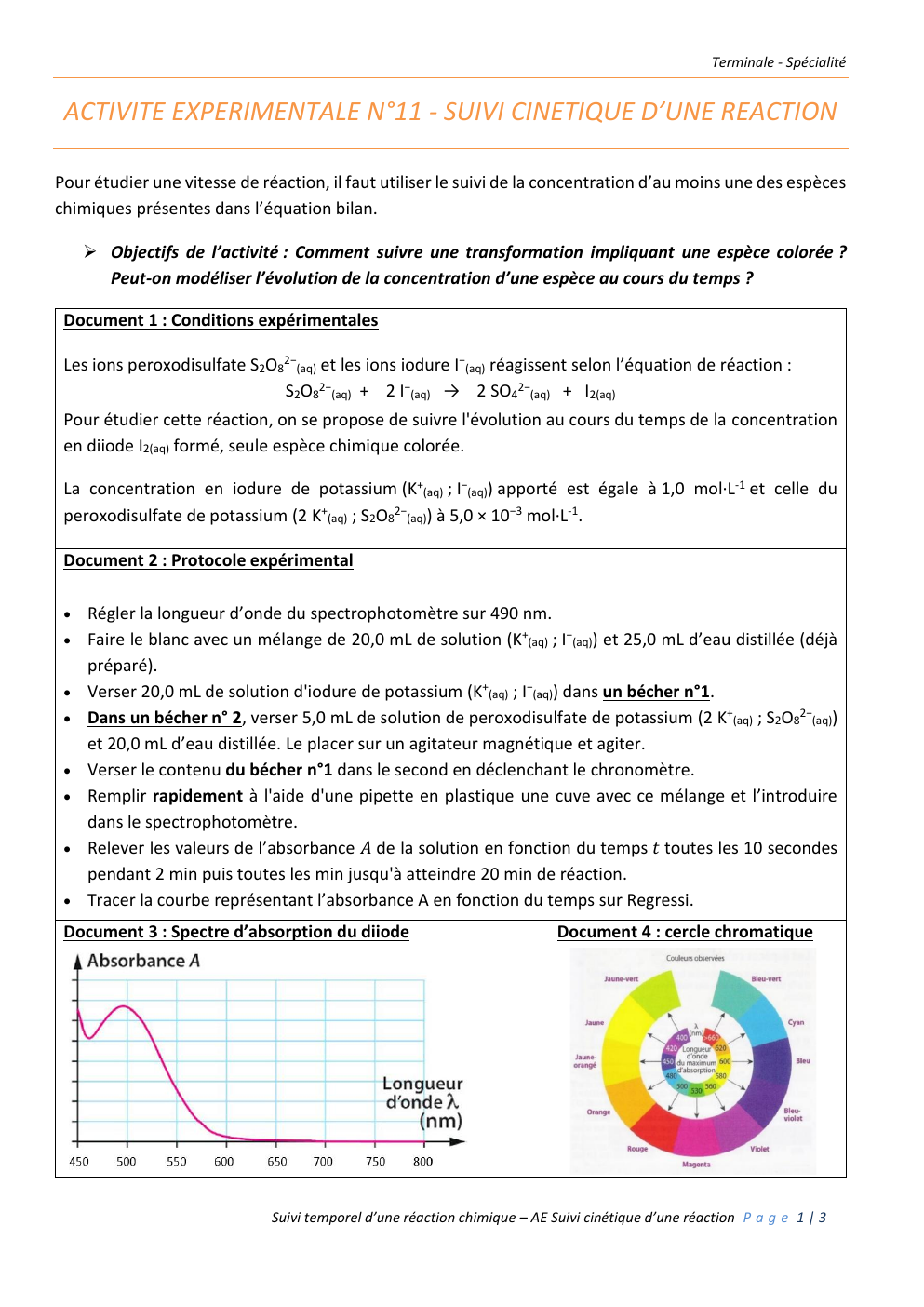
Document 3 : Spectre d’absorption du diiode
Document 4 : cercle chromatique
Suivi temporel d’une réaction chimique – AE Suivi cinétique d’une réaction P a g e 1 | 3
Terminale - Spécialité
Complément scientifique :
- Loi de Beer-Lambert : L’absorbance et la concentration de
l’espèce colorée sont proportionnelles : A = k × C
- Temps de demi-réaction t1/2 : C’est le temps pour lequel la
valeur de l’avancement est égal à la moitié de l’avancement
final ou à la moitié de l’avancement maximal si la
transformation est totale (𝑥𝑓 = 𝑥𝑚𝑎𝑥 ).
C’est aussi la durée
durant laquelle la concentration du réactif limitant a
diminué de moitié.
- Vitesse volumique de formation et de disparition :
QUESTIONS
1) Réaliser le protocole expérimental du doc.
2.
Afin de gagner du temps, vous rentrerez directement
les valeurs de l'absorbance dans Regressi.
2) Prévoir la couleur de la solution en fin d’expérience.
Justifier le choix de la spectrophotométrie
comme technique de suivi cinétique ainsi que le choix de la longueur d’onde utilisée pour réaliser
les mesures.
3) A l’aide du tableau d’avancement ci-dessous, déterminer la concentration....
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- TP n°11 Spécialité Physique-Chimie (Première) Mouvements et interactions Mouvements et forces
- résumé optique terminale générale
- HGGSP terminale AXE 1 - Histoire et mémoires des conflits
- Le cancer, BPH, cours terminale ST2S
- svt climats du passé spécialité