LA LIAISON CHIMIQUE
Publié le 27/01/2019

Extrait du document
La liaison chimique
trois types de liaison forte : la liaison covalente, la liaison ionique et la liaison métallique. En pratique, une liaison chimique forte est un intermédiaire entre ces trois types de liaison. Parmi les liaisons chimiques faibles, on distingue principalement les liaisons par force de Van der Waals et les liaisons hydrogène. Les premières sont des interactions électrostatiques qui s'établissent à faible distance entre les molécules d'un même composé (liaison intermoléculaire). La liaison hydrogène intervient dans des molécules où un atome d'hydrogène (H) est lié à un atome très électronégatif (fluor, oxygène, azote), c'est-à-dire qui a tendance à attirer fortement vers lui les électrons de sa liaison avec l'hydrogène.
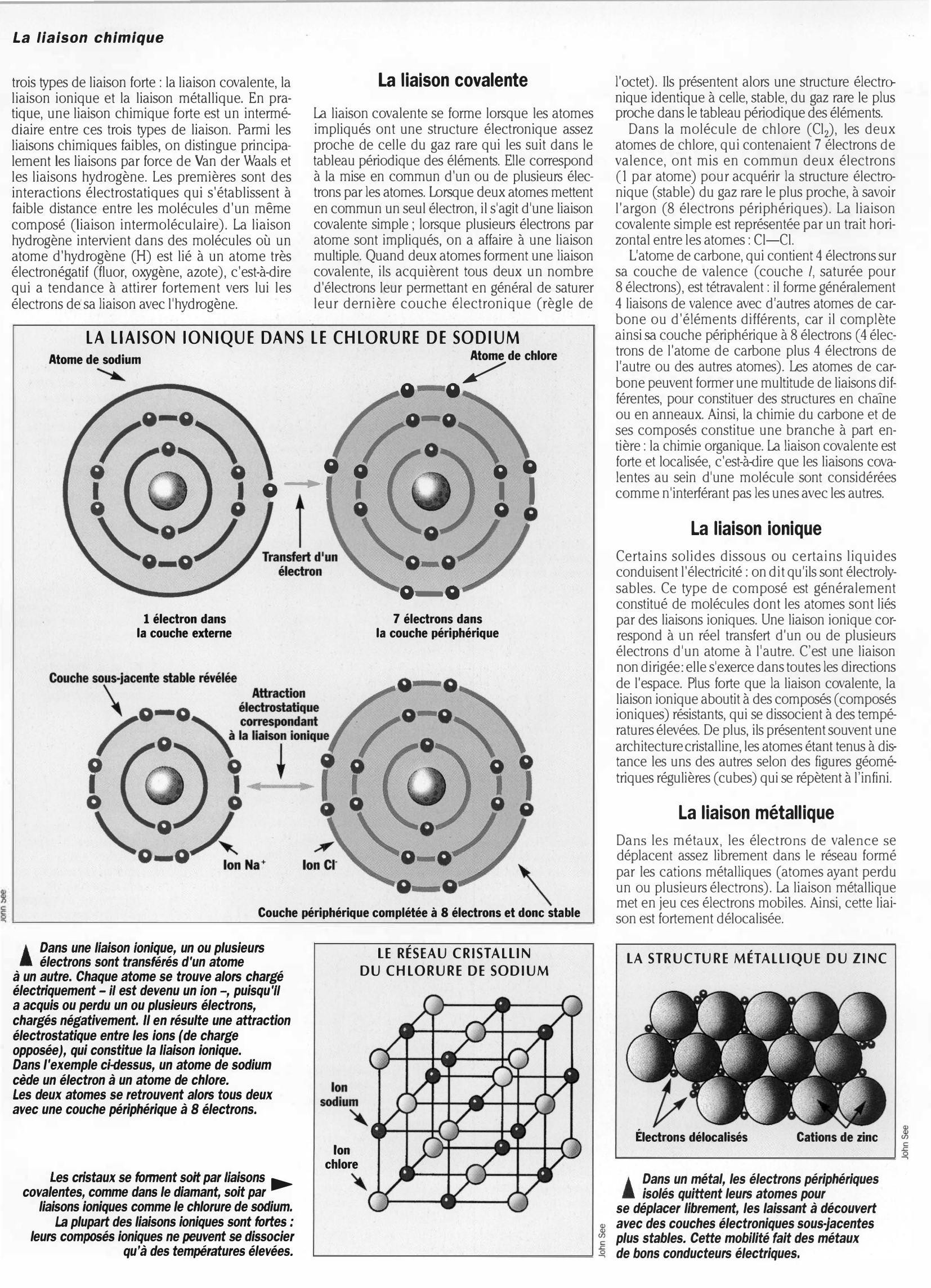
LA LIAISON IONIQUE DANS LE CHLORURE DE SODIUM
Atome de sodium
LesK
S i
i \\
Transfert d'un électron
1 électron dans la couche externe
7 électrons dans la couche périphérique
La liaison covalente
La liaison covalente se forme lorsque les atomes impliqués ont une structure électronique assez proche de celle du gaz rare qui les suit dans le tableau périodique des éléments. Elle correspond à la mise en commun d'un ou de plusieurs électrons par les atomes. Lorsque deux atomes mettent en commun un seul électron, il s'agit d'une liaison covalente simple ; lorsque plusieurs électrons par atome sont impliqués, on a affaire à une liaison multiple. Quand deux atomes forment une liaison covalente, ils acquièrent tous deux un nombre d'électrons leur permettant en général de saturer leur dernière couche électronique (règle de
Atome de chlore
8 0
1
l'octet). Ils présentent alors une structure électronique identique à celle, stable, du gaz rare le plus proche dans le tableau périodique des éléments.
Dans la molécule de chlore (Cy, les deux atomes de chlore, qui contenaient 7 électrons de valence, ont mis en commun deux électrons (1 par atome) pour acquérir la structure électronique (stable) du gaz rare le plus proche, à savoir l'argon (8 électrons périphériques). La liaison covalente simple est représentée par un trait horizontal entre les atomes : Cl—Cl.
L'atome de carbone, qui contient 4 électrons sur sa couche de valence (couche /, saturée pour 8 électrons), est tétravalent: il forme généralement 4 liaisons de valence avec d'autres atomes de car
«
La
liaison chimique
trois types de liaison forte : la liaison covalente, la
liaison ionique et la liaison métallique.
En pra
tique, une liaison chimique forte est un intermé
diaire entre ces trois types de liaison.
Parmi les
liaisons chimiques faibles, on distingue principa
lement les liaisons par force de Van der Waals et
les liaisons hydrogène.
Les premières sont des
interactions électrostatiques qui s'établissent à
faible distance entre les molécules d'un même
composé (liaison intermoléculaire).
La liaison
hydrogène intervient dans des molécules où un
atome d'hydrogène (H) est lié à un atome très
électronégatif (fluor, oxygène, azote), c'est-à-dire
qui a tendance à attirer fortement vers lui les
électrons de sa liaison avec l'hydrogène.
La
liaison covalente
La liaison covalente se forme lorsque les atomes
impliqués ont une structure électronique assez
proche de celle du gaz rare qui les suit dans le
tableau périodique des éléments.
Elle correspond
à la mise en commun d'un ou de plusieurs élec
trons par les atomes.
Lorsque deux atomes mettent
en commun un seul électron, il s'agit d'une liaison
covalente simple ; lorsque plusieurs électrons par
atome sont impliqués, on a affaire à une liaison
multiple.
Quand deux atomes forment une liaison
covalente, ils acquièrent tous deux un nombre
d'électrons leur permettant en général de saturer
leur dernière couche électronique (règle de
LA LIAISON IONIQUE DANS LE CHLORURE DE SODIUM
Atome de chlore
8 8/ f/:: o":\
Atome de sodium
..........
8 0 8 0
e _..
1
1 1
1 électron dans
la couche externe o
-o
7 électrons dans
la couche périphérique
Couche périphérique complétée à 8 électrons et donc stable
i Dans une liaison Ionique, un ou plusieurs
A électrons sont transférés d'un atome
à un autre.
Chaque atome se trouve alors chargé
électriquement- il est devenu un fon -, puisqu'il
a acquis ou perdu un ou plusieurs électrons,
chargés négativement.
Il en résulte une attraction
électrostatique entre les ions (de charge
opposée), qui constitue la liaison ionique.
Dans l'exemple ci-.
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- U.F.R. BIOMEDICALE PCEM 1 Médecine René Descartes LA LIAISON CHIMIQUE 1 Document Médecine René Descartes
- LA LIAISON CHIMIQUE Les liaisons chimiques sont de deux types : covalentes ou ioniques.
- Liaison chimique o Généralités sur la liaison o Modèle de Lewis et types de liaisons o Géométrie des molécules - Règle de Gillespie P.
- Liaison chimique forte o Orbitales moléculaires et molécules diatomiques o Orbitales moléculaires et molécules polyatomiques P.
- UFR de Chimie Année 2008-2009 Licences Sciences et Technologies SVTE Devoir surveillé de l'UE "liaison chimique et interactions moléculaires" du S2 15 mai 2009 Durée 1 h 30- calculatrices non autorisées - documents non autorisés Indiquez sur votre copie le numéro de votre groupe de TD.