Étude cinétique de la dismutation du peroxyde d'hydrogène Polynésie, septembre 1996 (5 points)
Publié le 17/11/2014

Extrait du document
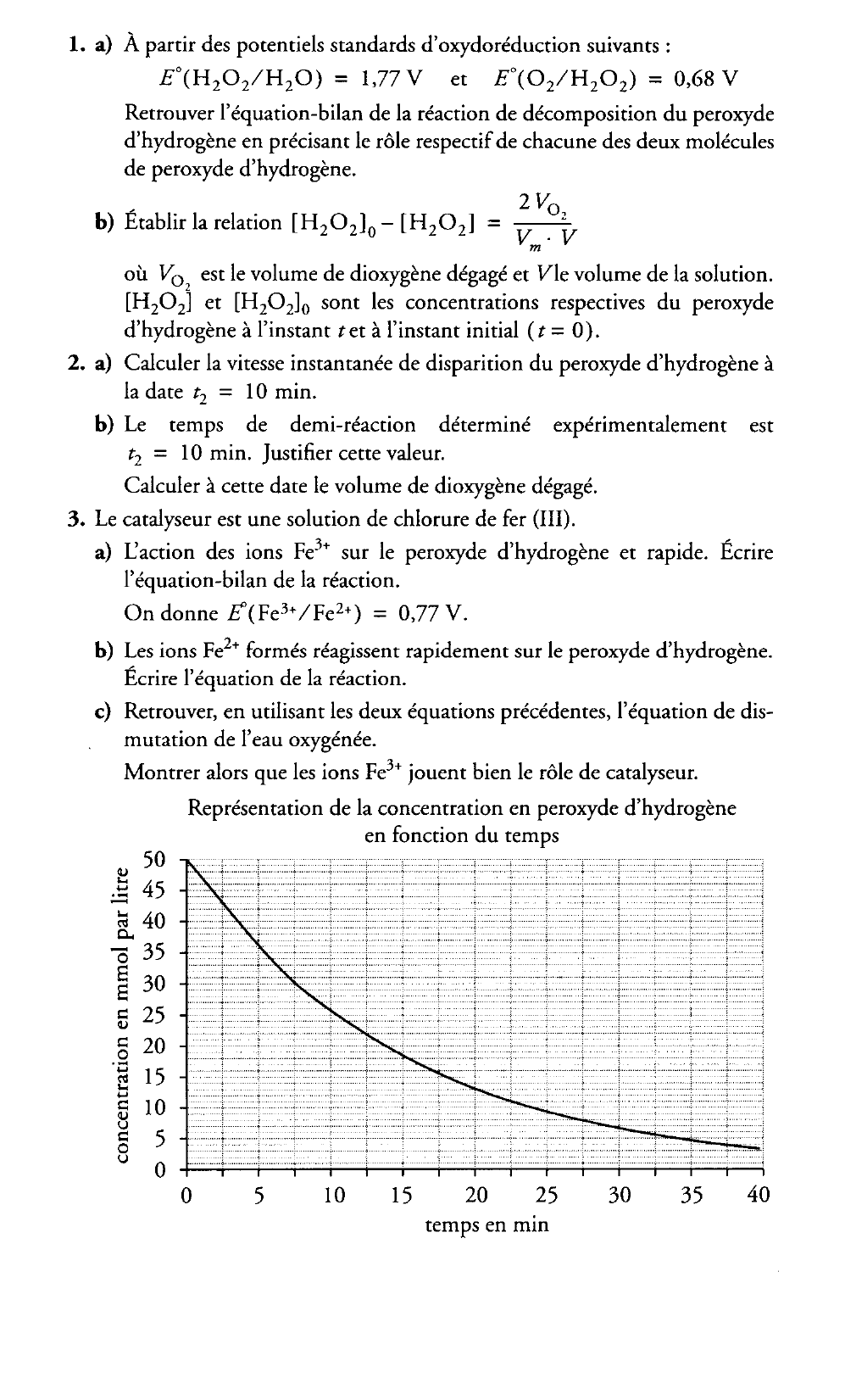
1.a) Calculer la vitesse instantanée de disparition du peroxyde d'hydrogène à
la date t2 = 10 min.
b) Le temps de demi-réaction déterminé expérimentalement est
t2 = 10 min. Justifier cette valeur.
Calculer à cette date le volume de dioxygène dégagé.
2.Le catalyseur est une solution de chlorure de fer (III).
a) Laction des ions Fe3+ sur le peroxyde d'hydrogène et rapide. Écrire
l'équation-bilan de la réaction.
On donne r(Fe3+/Fe2+) = 0,77 V.
b) Les ions Fel' formés réagissent rapidement sur le peroxyde d'hydrogène. Écrire l'équation de la réaction.
c) Retrouver, en utilisant les deux équations précédentes, l'équation de dis‑
mutation de l'eau oxygénée.
L'eau oxygénée est une solution aqueuse de peroxyde d'hydrogène qui se
décompose suivant l'équation-bilan :
2H202 -p 02 + 2H20
On se propose d'étudier, à température constante, la cinétique de cette réaction. On admettra que la décomposition se fait sans changement de volume de la solution et que le volume molaire gazeux, dans les conditions de l'expérience, est Vin = 24 L • mol-1.
On ajoute à un volume V = 100 mL d'eau oxygénée quelques gouttes d'un catalyseur. À différentes dates t, on effectue des prélèvements du mélange. On dose le peroxyde d'hydrogène restant à l'aide d'une solution acidifiée de permanganate de potassium.
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- Distance de freinage Polynésie, septembre 1996 (5,5 points)
- L'eau de Javel Nouvelle Calédonie, septembre 1996 (3,5 points)
- Étude de la vitesse de disparition du peroxyde d'hydrogène en présence d'ions ferriques Fe3+
- Étude d'un circuit série : conducteur ohmique et bobine Polynésie, juin 1997 (6 points)
- Le cyclotron - Métropole, septembre 1996 (5,5 points)