Cinétique chimique Cinétique de l'oxydation des ions iodure par les ions peroxodisulfate
Publié le 17/11/2014

Extrait du document
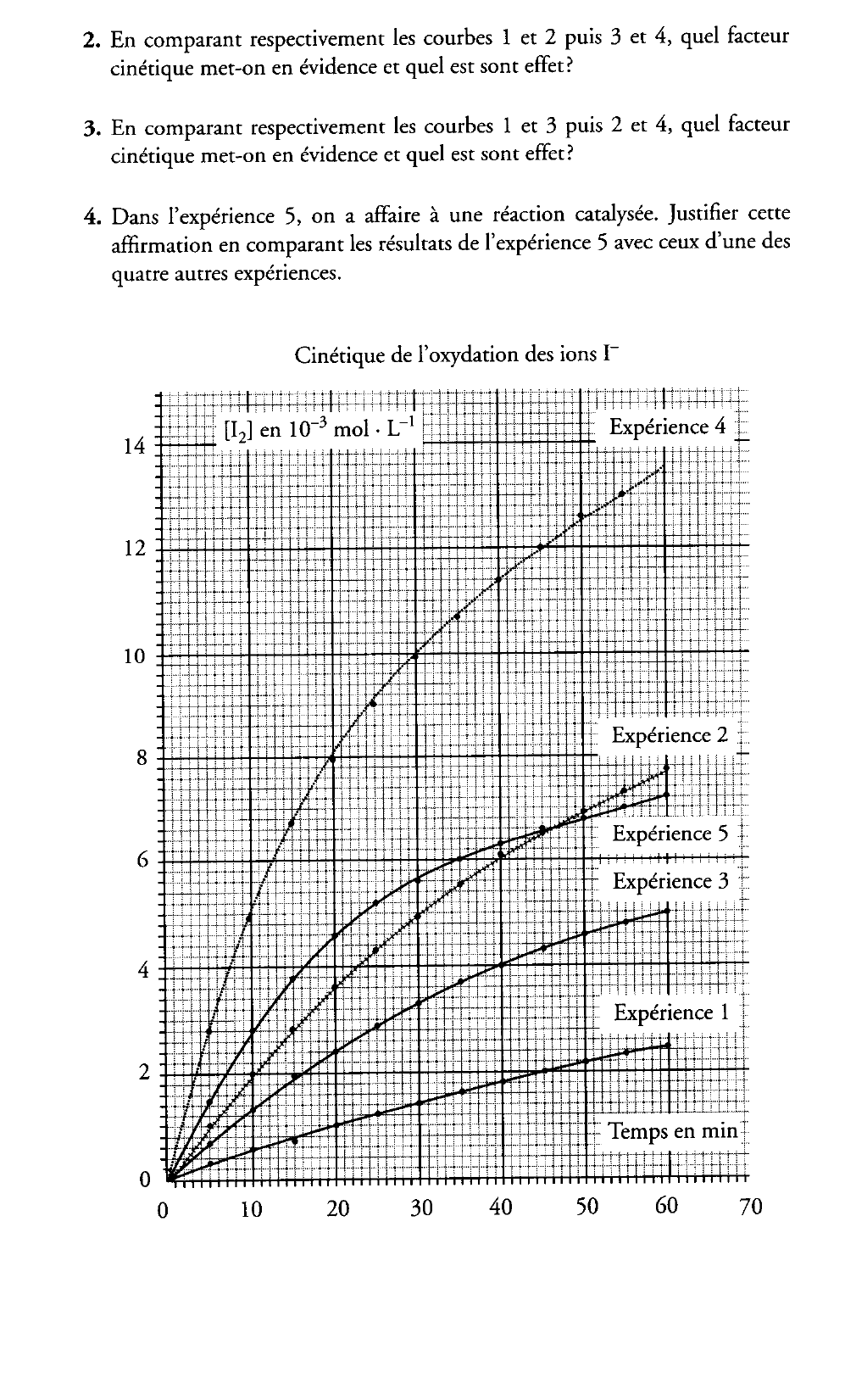
2. Les courbes 1 et 2 sont obtenues avec la même température (20 °C) et sans catalyseur.
Le facteur cinétique mis en évidence est la concentration des réactifs. Plus cette concentration est grande plus la vitesse est grande.
De même les courbes 3 et 4 sont obtenues à 35 °C et sans catalyseur. Là encore la concentration des réactifs augmente la vitesse de réaction.
3. Les courbes 1 et 3 sont obtenues pour des concentrations de réactifs identiques et sans catalyseur mais pour des températures différentes. On constate que plus la température est élevée plus la vitesse est grande.
Même constatation pour les courbes 2 et 4.
La température est un facteur cinétique, plus elle est élevée plus la vitesse est grande.
4. On peut comparer l'expérience 1 et l'expérience 5 parce que les concentrations des réactifs sont les mêmes et que la température est la même. Le seul facteur cinétique que l'on teste est le catalyseur. On constate que la présence d'un catalyseur augmente la vitesse de la réaction.
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- Cinétique de la réaction de l'eau oxygénée avec les ions iodure
- PACES 2011-2012 UE spé Pharma ED -cinétique Exercice 1 : L'oxydation de l'ammoniac entraîne la formation d'eau et de NO a) équilibrer la réaction -1 -1 Si l'ammoniac disparaît à la vitesse de 0,2 mol.
- catalyse 1 PRÉSENTATION catalyse, modification de la vitesse d'une réaction chimique par une substance rajoutée, appelée catalyseur, que l'on retrouve inaltérée en fin de réaction et qui ne modifie pas l'équilibre thermodynamique de cette dernière (voir cinétique).
- cinétique chimique - chimie.
- STRUCTURES ET PROPRIETES DES MOLECULES ET DES IONS 1G SPE Chap.5 Objectifs : Etablir des schémas de Lewis et géométrie de molécules Déterminer les caractères polaire d’une liaison, d’une molécule.