CHIMIE ORGANIQUE ET FONCTIONS ORGANIQUES
Publié le 23/12/2011

Extrait du document

Il existe des millions de composés organiques différents depuis le méthane jusqu'aux molécules biologiques d'une complexité inouïe; chaque année des dizaines de milliers de nouveaux corps organiques sont synthétisés ou i11olés. On comprend qu'il soit vital pour les organiciens de mettre un certain ordre dans cet énorme ensemble. Heureusement à l'instar de la chimie minérale, il existe des familles de corps doués de propriétés voisines grâce à des groupements organiques identiques. Les corps les plus simples qui ont servi de point de départ à la classification sont composés exclusivement de carbone et d'hydrogène. Baptisés hydrocarbures, ils font appel aux liaisons simples, doubles, triples et aromatiques.

«
Ceci permettait d'expliquer des paradoxes apparents, comme les isomères, ces corps qui ont même poids moléculaire et une répartition identique des carbones et des hydrogènes, alors que leurs propriétés chimiques diffèrent.
Dans la deuxième moitié du XIx" siècle, la chimie organique entreprit sa mutation défini tive; de descriptive elle devint une chimie de synthèse, ce qu'elle est restée depuis.
C'est au génie de Berthelot que l'on doit à cette époque les premières synthèses de l'acide formique, du méthane, de l'acétylène; à celui de Wurtz et d'Hoffmann que l'on doit celles des hydrocar bures et des amines.
Parallèlement à cet effort théorique, une industrie chimique apparaissait; d'abord can tonnée dans la fabri-cation de matières colo rantes telles que la fuschine, l'alizarine, l'indigo, tirés des goudrons de houille, elle devait amor cer rapidement la révolution pétrolo-chimique qui devait marquer la première moitié de ce
siècle.
Le squelette de l'édifice organique
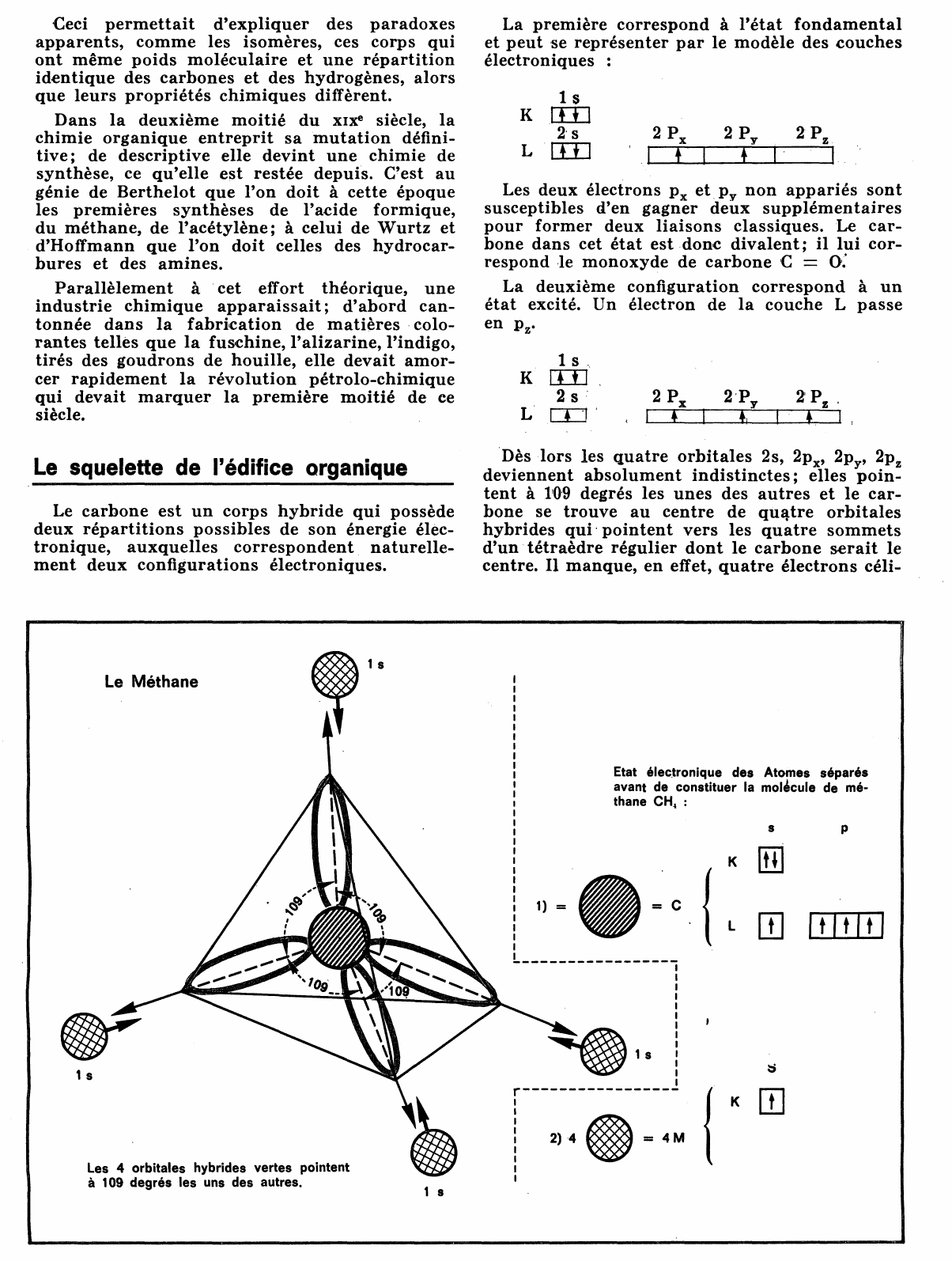
Le carbone est un corps hybride qui possède deux répartitions possibles de son énergie élec tronique, auxquelles correspondent naturelle ment deux configurations électroniques.
Le Méthane
1 s
Les 4 orbitales hybrides vertes pointent à 109 degrés les uns des autres.
1 s
La première correspond à l'état fondamental et peut se représenter par le modèle des couches électroniques
1 s K [il] 2 s L [II] 2 px
D
2 py 2 Pz
I
Les deux électrons Px et Pv non appariés sont susceptibles d'en gagner deux supplémentaires pour former deux liaisons classiques.
Le car bone dans cet état est donc divalent; il lui cor respond le monoxyde de carbone C = o:
La deuxième configuration correspond à un état excité.
Un électron de la couche L passe en Pz·
1 s K [il] 2 Px 2 py 2Pz 2 s
1 J, 1 I L o::::J 1 I
Dès lors les quatre orbitales 2s, 2px, 2pY, 2pz deviennent absolument indistinctes; elles poin tent à 109 degrés les unes des autres et le car bone se trouve au centre de qu~tre orbitales hybrides qui· pointent vers les quatre sommets d'un· tétraèdre régulier dont le carbone serait le centre.
Il manque, en effet, quatre électrons céli-
1)
Etat élec.tronique des Atomes séparés
avant de constituer la molecule de mé thane CH, :
p
cr
[ill
OJ 1 t 1 t 1 t 1
-----------------ï 1
1 1 1 1 1 1 1 s : 1
1
r----------------1
2)4 ® = 4M
:;
{ '
OJ.
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- MECANISMES REACTIONNELS EFFETS ELECTRONIQUES La compréhension des mécanismes réactionnels en chimie organique passe par la compréhension des effets électroniques.
- 16/09/2011 Jean-Claude Gesquiere Laboratoire de Chimie Organique Faculté de Pharmacie Inserm U761 Biostructures et Découverte
- PACES 2011-2012 ED chimie organique Rq : des QCM en ligne sont disponibles sur le campus virtuel pour vous entraîner.
- Corrigé BAC série D 2013 I CHIMIE ORGANIQUE : (3 points) Montrons que n= 4 Equation-bilan : Cn H 2n O ?
- organique, chimie - chimie.