Les éthers
Publié le 04/04/2019
Extrait du document
Cette capacité de s'associer aux cations est mise à profit dans les éthers couronnes qui sont des polyéthers cycliques qui comprennent des motifs de type 1,2-dioxyéthane.
H3C—C-O K
éther 18-couronne-6
O
+
Il .
H3C—C-O
Ion acétate \"nu \" nettement meilleur nucléophile
avec KMnO4 obtention d'une solution benzénique permettant les oxydations en solvant organique
Jean-Marie Lehn, prix Nobel de Chimie en 1987
7
Réactions de coupure des éthers
Par les acides Forts
HI HC—I
R—O—CH R—O—CH 3 HI
3 h 3 I R—OH * R—I
Nécessite à la fois un acide très fort pour protoner l'oxygène
un nucléophile fort tel que I- ou Br-
peut être utilisé pour protéger des phénols qui ne réagissent pas avec HI
Protection d'alcools sous forme d'éthers tertiobutyliques
CH
I * 3
R— O—C—CH3
h2so4
50°C
CH3
CH
C 3
R C—CH,
H C 3
R—OH
H2C—H^ O\" I
O=S—OH
H C CH
3 3
1 C
HC
Propriétés Physiques
Molécules polaires
Liquides volatils : tension de vapeur élevée Eb basse : MeOMe - 24 °C
MeOEt +10°C
R
O
X
✓
EtOEt +34 °C (BuOH +117°C)
R
Entre molécules d'éther, pas d'association de type liaison H, uniquement VdW
Point d'inflammation très bas
Solubilité dans l'eau : voisine de celle des alcools de même poids moléculaire
Éther : exemple de l'éther éthylique éther dans eau 8g/100 mL à 15°C (butanol 9,1) eau dans éther 1,2 % à 20°C solubles dans les graisses et hydrocarbures mauvais solvant de l'eau bon solvant de nombreux composés organiques hydrophobes bon solvant d'extraction
Toxicité : éther éthylique et éther vinylique = anesthésiques risques : inflammabilité et peroxydes
3
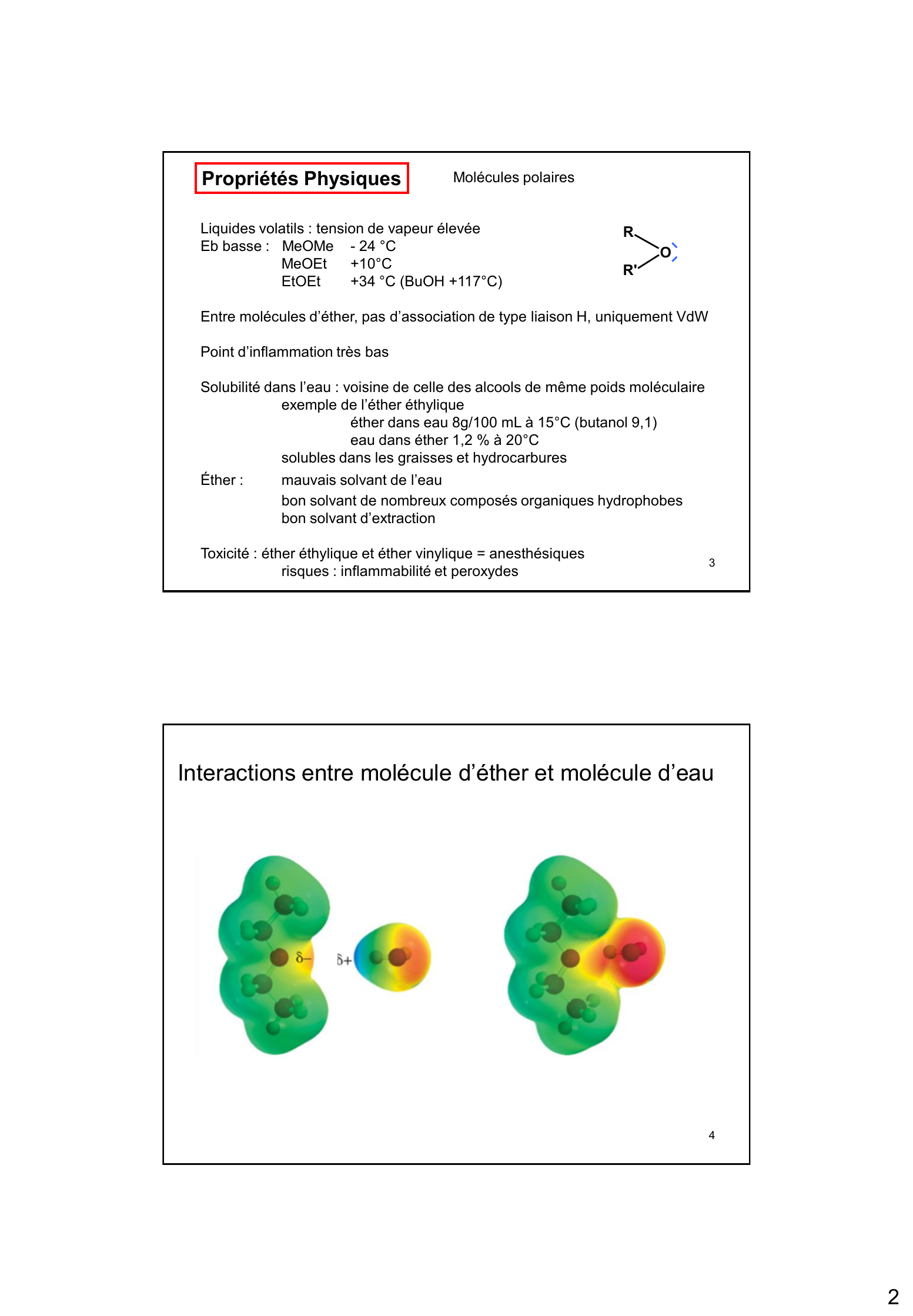
Interactions entre molécule d'éther et molécule d'eau
Propriétés Physiques
Composés volatils température d'ébullition basse
H,C—CH,
2 2 Eb : 15°C
O
Les composés de faible poids moléculaires sont solubles dans l'eau
- sont accepteurs de liaisons hydrogène
Très réactifs, ils sont utilisés pour la stérilisation de matériel chirurgical
Propriétés Chimiques
h2c-ch2 O cycle triatomique / angles voisins de 60 ° très forte tension qui confère une réactivité très importante Liaison C-O polarisée : c cible des nucléophiles Présence de doublets non liants - basicité - nucléophilie
Les réactions se feront avec ouverture du cycle
13
« 2 3 Propriétés Physiques Liquides volatils : tension de vapeur élevée Eb basse : MeOMe - 24 °C MeOEt +10 °C EtOEt +34 °C ( BuOH +117 °C) Entre molécules d’éther, pas d’association de type liaison H, uniquement VdW Point d’inflammation très bas Solubilité dans l’eau : voisine de celle des alcools de même poids moléculaire exemple de l’éther éthylique éther dans eau 8g/100 mL à 15 °C (butanol 9,1) eau dans éther 1,2 % à 20 °C solubles dans les graisses et hydrocarbures Éther : mauvais solvant de l’eau bon solvant de nombreux composés organiques hydrophobes bon solvant d’extraction Toxicité : éther éthylique et éther vinylique = anesthésiques risques : inflammabilité et peroxydes Molécules polaires 4 Interactions entre molécule d’éther et molécule d’eau R O R '. »
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- U.F.R. BIOMEDICALE PCEM 1 Médecine René Descartes Les thiols Les éther-oxydes Les thio-éthers 1 Document Médecine René
- Les éthers 1 Les éthers O R O O R' R Ar Ar Ar' Dérivés disubstitués de l'eau, par des groupes alkyle
- éthers - chimie.