Hydrocarbures aromatiques 1 Il est possible d'écrire deux structures en résonance/ mésomères de la molécule de benzène.
Publié le 02/10/2014

Extrait du document
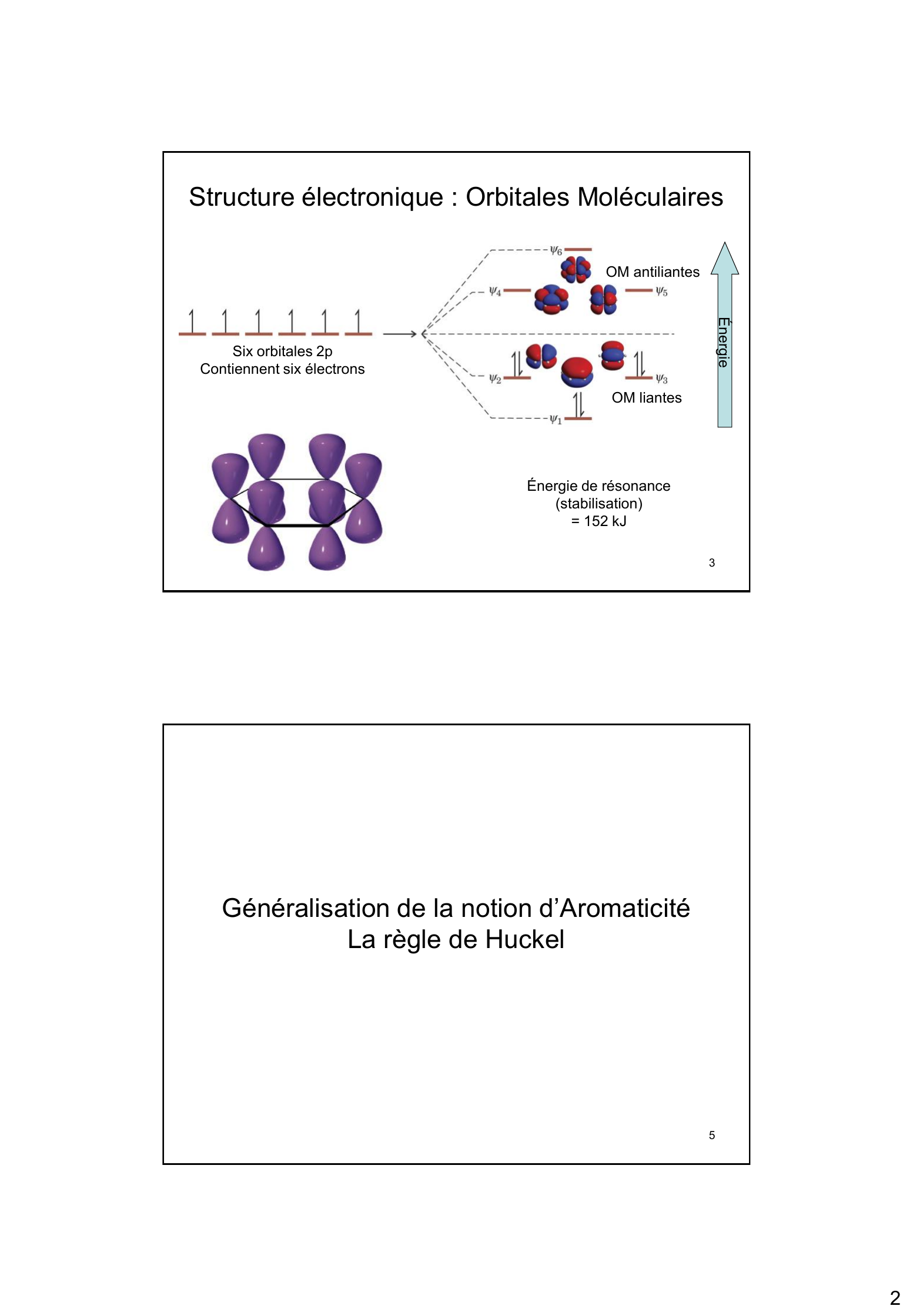
Hydrocarbures aromatiques 1 Il est possible d'écrire deux structures en résonance/ mésomères de la molécule de benzène. H H H H H H L'hybride de résonance est beaucoup plus stable que les deux formes mésomères Les 6 électrons délocalisés peuvent être représentés par un cercle 2 1 Structure électronique : Orbitales Moléculaires OM antiliantes Énergie Six orbitales 2p Contiennent six électrons OM liantes Énergie de résonance (stabilisation) = 152 kJ 3 Généralisation de la notion d'Aromaticité La règle de Huckel 5 2 Le cyclooctatétraène n'est pas aromatique Le cyclooctatétraène n'est pas plan Préparé pour la première fois en 1905 H H H H H H H H Molécule peu stable, comportement similaire à celui d'un alcène Absence de recouvrement 6 Règle de Huckel Pour qu'un composé soit aromatique, il faut : Un système cyclique plan Chaque atome du cycle doit possèder une orbitale 2p assurant un domaine continu de circulation des électrons Le nombre d'électrons délocalisés doit correspondre à 4n+2 (n étant un nombre entier). 7 3 Ions dérivés du Cyclopentadiène ? Le cation avec une orbitale 2p vacante n'a que 4 électrons. ? L'anion avec une orbitale 2p doublement occupée a 6 électrons. - H- - H+ H 4 électrons P ? Anti-aromatique _ sp3 + H HH Doublet électronique dans l'orbitale 2p Orbitale 2p vacante 6 électrons P ? aromatique 8 Doublet électronique dans l'orbitale 2p 6 électrons P ? aromatique Le pKa du cyclopentadiène est de 16, ce qui correspond à une acidité nettement supérieure à celle des alcanes (~ 40) _ HH + H+ p KA = 1 6 H 9 4 Héterocycles Aromatiques comportant 6 sommets L'azote contribue par 1 électron à l'aromaticité Le doublet électronique de l'azote est présent dans une orbitale sp2 située dans le plan du cycle N Pyridine 6 électrons P 10 Heterocycles Aromatiques comportant 5 sommets L'azote contribue par 2 électrons à l'aromaticité NH Pyrrole 6 électrons P 11 5 Propriétés Chimiques Substitution Electrophile Aromatique ? Nécessite un catalyseur ? Bilan de Substitution (et non d'addition) ? Préserve l'aromaticité ? Attaque initiale par un réactif électrophile H + E + + E+ H 12 Formation d'un complexe sigma stabilisé par résonance H E+ H + + E E H + H E + + H + E + 14 Complexe sigma 6 Énergie libre Étape 2 : Perte d'un proton à partir du carbocation Produit d'addition Produit de substitution Avancement de la réaction La substitution est favorisée car à la différence de l'addition, elle permet une ré-aromatisation 15 Preuve du passage par le complexe ? CH3 CH3 HF / BF3 H3C BF4 + - 80°C H3C CH3 CH3 H H Solide jaune brillant F° = -15°C Se décompose par chauffage Intérêt de la protonation : préparation de dérivés deutériés ou tritiés D + + + D2O H D HOD D 16 7 Exemples de SEAr 17 Halogénation du Benzène Utilisation de catalyseurs, acides de Lewis : AlBr3, AlCl3, FeCl3, SbCl5, BF3... Br Br Br Br Fe Br Br + Fe Br + Br Br Br Br + Br _ + H + Br + +H Le chlore et le Brome (mais pas le fluor qui est trop réactif) donnent des réactions de substitution en présence d'acides de Lewis. 18 8 État de transition limite la vitesse énergie réactifs intermédiaires produits ?H fonction de l'électrophile Déroulement de la réaction Réactivité fonction de la nature de l'halogène : F2 : trop réactif Cl2, Br2 : réaction satisfaisante I2 : bilan endothermique nécessite des ions I+ + I2 + AgClO4 I ClO4 + Ag+ l 19 4/ Nitration du benzène H HNO3 NO2 H2SO4 o Mélange d'acide nitrique et d'acide sulfurique o La réaction avec le benzène conduit au nitrobenzène 20 9 H NO2 HNO3 Nitrobenzène H2SO4 Acide nitrique Ion nitronium Nitrobenzène Preuve : nitration possible par NO2+ ClO4- ou par NO2+ PF6- 21 Le nitrobenzène n'est souvent qu'un intermédiaire: Par hydrogénation, le Nitrobenzène conduit à l'aniline NO2 H 2 Pt basse pression NH2 Aniline Dans ces conditions, il n'y a pas hydrogénation de l'aromatique 22 10 5/ Sulfonation du benzène H SO3H SO3 H2SO4 Acide Benzènesulfonique ? Réaction avec un mélange d'acide sulfurique et de SO 3 : oléum ? L'espèce réactive est SO3 ou son acide conjugué ? La réaction est réversible dans une solution aqueuse acide diluée 23 Sulfonation du benzène Acide benzènesulfonique Réaction effectuée en milieu anhydre 24 11 La sulfonation est une réaction réversible H+ / ? H + - SO3 H La protonation en position 1 n'est pas la plus favorable, mais elle est la seule à conduire à un produit différent ... Rôle important pour la protection réversible de certaines positions sur des HC aromatiques 25 6/ Alkylation du Benzène: Réaction de Friedel-Crafts + R X AlCl3 R H + AlCl4 R-X : dérivé halogéné (X= Cl ou Br) ? Préparation d'alkylbenzènes à par...
« 2 3 Structure électronique : Orbitales Moléculaires Six orbitales 2p Contiennent six électrons OM antiliantes OM liantes Énergie Énergie de résonance (stabilisation) = 152 kJ 5 Généralisation de la notion d’Aromaticité La règle de Huckel. »
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- STRUCTURES ET PROPRIETES DES MOLECULES ET DES IONS 1G SPE Chap.5 Objectifs : Etablir des schémas de Lewis et géométrie de molécules Déterminer les caractères polaire d’une liaison, d’une molécule.
- « La politique de la littérature n'est pas la politique des écrivains. Elle ne concerne pas leurs engagements personnels dans les luttes politiques et sociales de leur temps. Elle ne concerne pas non plus la manière dont ils représentent dans leurs livres les structures sociales, les mouvements politiques ou les identités diverses. L'expression « politique de la littérature » implique que la littérature fait de la politique en tant que littérature. Elle suppose qu'il n'y a pas à se dem
- Peut-on tout dire, tout écrire, tout montrer, quand on est journaliste ?
- SOMMAIRE MATHS CM2 Numération CM2 Lire et écrire les nombres entiers jusqu'à
- Imaginer et écrire un conte « Imaginer comment les hommes ont inventé les bateaux » Imagine où et quand vivaient ces hommes.